
Peter Tucker
0
1895
26
Naukowcy mogą wreszcie zrozumieć tajemnicze przemiany stojące za stuletnim eksperymentem chemicznym. Szczegóły tej transformacji, w której dodanie elektronów do jasnoniebieskiego roztworu amoniaku przekształca go w błyszczący, metaliczny brąz, dawno umykały naukowcom.
Nowe badanie ujawnia subtelne szczegóły tej zmiany i pokazuje, że ta transformacja jest raczej stopniowa niż nagła. „To, co udało nam się z powodzeniem, to fakt, że prawie zrozumieliśmy, jak te rozwiązania zachowują się w szerokim zakresie stężeń przy użyciu techniki mikrorozdziałów” - powiedział współautor badania Ryan McMullen, doktorant chemii na University of Southern California . Ta technika, która polega na wystrzeliwaniu cienkich jak włos strumieni roztworu przez próżnię, nie była wcześniej stosowana do błyszczącej cieczy..
Odkrycie może otworzyć w przyszłości nowe typy reakcji w chemii organicznej, powiedział McMullen .
Związane z: 8 pierwiastków chemicznych, o których nigdy nie słyszałeś
Co to jest metal?
Metale to zróżnicowana grupa. Niektóre, jak lit, są wystarczająco lekkie, aby unosić się na wodzie, podczas gdy inne, takie jak ołów lub osm, są wyjątkowo gęste. Niektóre wymagają niewiarygodnie wysokich temperatur do stopienia, podczas gdy inne łatwo się topią (na przykład rtęć topi się w temperaturze minus 38,3 stopnia Celsjusza lub minus 37,9 stopnia Fahrenheita). Ostatecznie to, co łączy metale, to ich zdolność do przewodzenia energii elektrycznej przy zera absolutnym, punkcie, w którym ruch molekularny od ciepła zasadniczo zatrzymuje się..
Ale w jaki sposób niektóre niemetale przekształcają się w metale? W nowym badaniu naukowcy odpowiedzieli na to pytanie, dodając metale do ciekłego amoniaku.
Najpierw naukowcy skondensowali amoniak, który jest gazem w temperaturze pokojowej, w ciecz poprzez schłodzenie go do ujemnych 27,4 F (minus 33 C). Następnie dodali sód, lit lub potas, które są metalami alkalicznymi. (Raczej słynne metale te reagują wybuchowo po zanurzeniu w wodzie.) Eksperymenty zostały przeprowadzone we współpracy z naukowcami z Czeskiej Akademii Nauk i Fritz-Haber Institute z Towarzystwa Maxa Plancka w Berlinie, a także z naukowcami z Japonii i Francji..
Związane z: 10 największych eksplozji wszechczasów
Rezultatem była oczekiwana reakcja: ciekły amoniak wyciągnął elektrony z metalu. Elektrony te zostały następnie uwięzione między cząsteczkami amoniaku, tworząc tak zwane solwatowane elektrony, które naukowcy mieli nadzieję zbadać. Przy niskich stężeniach wynikiem była niebieska, niemetaliczna ciecz. Jednak gdy solwatowane lub uwięzione elektrony gromadziły się, roztwór przeszedł w błyszczący brąz.
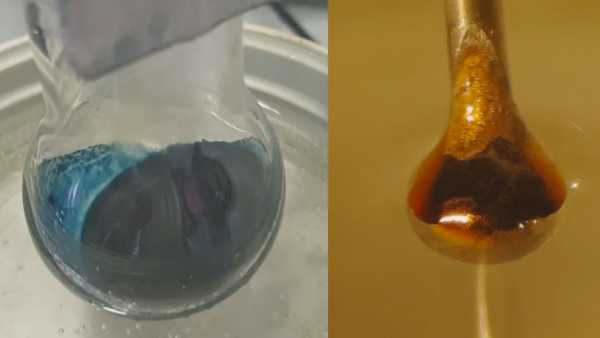
Następnym wyzwaniem było zbadanie, jak solwatowane elektrony zachowują się przy różnych stężeniach. Polegało to na wystrzeleniu mikrowystępu roztworu - mniej więcej na szerokość ludzkiego włosa - przez wiązkę promieni rentgenowskich synchrotronów, które są wiązkami promieniowania rentgenowskiego o wysokiej energii. Promienie rentgenowskie wzbudziły solwatowane elektrony, powodując, że wyskoczyły z ich płynnej klatki z cząsteczkami amoniaku. Naukowcy mogli następnie zmierzyć, ile energii potrzeba do uwolnienia solwatowanych elektronów.
Naukowcy odkryli, że im większe stężenie solwatowanych elektronów, tym bardziej wzór uwalniania energii odpowiada temu, co widać w metalu. Oto, co to oznacza: jeśli wykreślisz ilość energii potrzebnej do uwolnienia elektronów z ich ciekłej klatki amoniakalnej, metale zazwyczaj mają tak zwane „krawędzie Fermiego”, bardzo nagłe przejście, powiedział McMullen. Przy niższych stężeniach solwatowanych elektronów ten wykres uwalniania energii wygląda bardziej jak zaokrąglone wzgórze. Dopiero przy wyższych stężeniach elektronów pojawiła się ta krawędź Fermiego. Krawędź odzwierciedla, ile energii mają elektrony w danej temperaturze, dodał McMullen.
„Gdy zwiększysz stężenie do zakresu metalicznego, zobaczysz, że pojawia się ten wspaniały wzór, który jest bardzo, bardzo charakterystyczny dla metalu” - powiedział McMullen.
Wyniki były interesujące, ponieważ pokazały, że podobna do metalu ciecz powstała w wyniku połączenia metali alkalicznych i amoniaku jest w rzeczywistości metalem na podstawowym poziomie fizycznym..
„To prawdziwy metal, a nie coś, co po prostu wygląda” - powiedział McMullen.
Solwatowane elektrony o niższym stężeniu są używane w reakcji zwanej reakcją Bircha, która dodaje elektrony do struktur molekularnych zwanych pierścieniami aromatycznymi. Tego rodzaju reakcja została wykorzystana do produkcji pierwszych doustnych tabletek antykoncepcyjnych w latach pięćdziesiątych XX wieku, powiedział McMullen. Powiedział, że dzięki zrozumieniu, w jaki sposób solwatowane elektrony działają w wysokich stężeniach, naukowcy mogą potencjalnie znaleźć nowe rodzaje reakcji chemicznych. Na przykład mogą wzbudzić solwatowane elektrony wiązkami światła, aby zmusić je do nowego zachowania.
"Jeśli połaskoczesz elektrony trochę, aby były bardziej podekscytowane energetycznie, możesz zacząć przyglądać się szalonym reakcjom, które nigdy by się nie wydarzyły" - powiedział McMullen.
Naukowcy poinformowali o swoich odkryciach 5 czerwca w czasopiśmie Science.
Zobacz wszystkie komentarze (2)














