
Gyles Lewis
0
2850
466
Uwaga redaktora: ta historia została zaktualizowana 17 sierpnia i zawierała:
- Dane z badania testującego szczepionkę Moderna na małpach makaków rezus
- Nowe dane fazy 1 / fazy 2 testujące kandydat na szczepionkę Sinopharm
- Dane dotyczące kandydata na szczepionkę firmy Johnson & Johnson
Korzystając z materiałów, od osłabionych wirusów przeziębienia po fragmenty kodu genetycznego, naukowcy na całym świecie tworzą dziesiątki unikalnych kandydatów na szczepionki do walki z nowym koronawirusem - i robią to z niespotykaną szybkością.
Ponad siedem miesięcy po tym, jak Światowa Organizacja Zdrowia (WHO) po raz pierwszy zaalarmowała świat o tajemniczej grupie przypadków zapalenia płuc w Wuhan w Chinach, 167 kandydatów na szczepionki jest w trakcie opracowywania, aby zapobiec koronawirusowi, który spowodował chorobę (zwanym COVID-19). WHO. Większość proponowanych szczepionek znajduje się na etapie przedklinicznym, co oznacza, że nadal są testowane na zwierzętach lub w laboratorium, ale kilka z nich przeszło testy na ludziach.
Takie badania kliniczne są podzielone na trzy do czterech etapów, przy czym wcześniejsze etapy (faza 1 / faza 2) badają bezpieczeństwo, dawkowanie i możliwe skutki uboczne oraz skuteczność (jak dobrze działa w zwalczaniu patogenu) kandydata na szczepionkę w mała grupa ludzi, według Food and Drug Administration (FDA). Kluczem do zatwierdzenia kandydata na szczepionkę są jednak obiecujące wyniki w bardziej zaawansowanych badaniach fazy 3.
Związane z: Aktualizacje na żywo dotyczące koronawirusa
W badaniach fazy 3 naukowcy testują skuteczność szczepionki, jednocześnie monitorując działania niepożądane u setek do tysięcy ochotników. FDA następnie zatwierdza szczepionkę, jeśli badania wykażą, że jest bezpieczna i skuteczna, a korzyści ze szczepionki przewyższają ryzyko, zgodnie z Centers for Disease Control and Prevention (CDC). Według WHO pięciu kandydatów na szczepionki koronawirusowe rozpoczęło rekrutację do badań III fazy lub przechodzi je. Oto najbardziej obiecujący z tych kandydatów:
Uniwersytet Oxford / AstraZeneca

Szczepionka obecnie nazywana ChAdOx1 nCoV-19, popularnie nazywana szczepionką Oxford, jest opracowywana przez brytyjski uniwersytet we współpracy z firmą farmaceutyczną AstraZeneca. Szczepionka jest zrobiona z osłabionej wersji wirusa przeziębienia, zwanego adenowirusem, który zakaża szympansy. Naukowcy zmodyfikowali genetycznie wirusa tak, aby nie mógł replikować się u ludzi i dodali geny do kodowania tak zwanych białek kolczastych, których koronawirus używa do infekowania ludzkich komórek. Teoretycznie szczepionka nauczy organizm rozpoznawania tych kolców, tak że gdy osoba zostanie narażona, układ odpornościowy może ją zniszczyć, zgodnie z poprzednim raportem..
Naukowcy wcześniej przetestowali tę szczepionkę na makakach rezusowych i stwierdzili, że nie zapobiegła ona zakażeniu małp podczas celowego narażenia na koronawirusa, ale zapobiegła rozwojowi zapalenia płuc, co sugeruje, że jest częściowo ochronna, zgodnie z badaniem opublikowanym 13 maja do bazy danych preprintów BioRxiv.
W kwietniu naukowcy rozpoczęli testowanie szczepionki na ludziach i opublikowali 20 lipca w czasopiśmie The Lancet wczesne wyniki swoich badań fazy 1 i fazy 2, które wciąż trwają. Szczepionka nie spowodowała żadnych poważnych skutków ubocznych u uczestników, ale wywołała pewne łagodne skutki uboczne, takie jak ból mięśni i dreszcze. Szczepionka pobudziła układ odpornościowy do produkcji komórek T swoistych dla SARS-CoV-2 - grupy białych krwinek ważnych w walce z patogenami - oraz neutralizujących przeciwciał lub cząsteczek, które mogą przyczepić się do wirusa i blokować go przed zakażeniem komórek , Według raportu.
Faza 3 prób już się rozpoczęła w Brazylii i zakwalifikuje do 5000 wolontariuszy. Oczekuje się, że kolejne badanie fazy 3 obejmie dodatkowe 10500 osób w Wielkiej Brytanii i 30 000 w Stanach Zjednoczonych, według strony internetowej Oxford testowej szczepionki i The New York Times. Zespół z Oksfordu wyraził również zainteresowanie przeprowadzeniem badań prowokacyjnych na ludziach, co oznacza, że celowo zakażaliby wirusem ochotników niskiego ryzyka, albo razem z próbami fazy 3, albo po ich zakończeniu, zgodnie z The Guardian.
Amerykański Departament Zdrowia i Opieki Społecznej (HHS) ogłosił, że przekaże AstraZeneca do 1,2 miliarda dolarów na przyspieszenie procesu opracowywania szczepionek i pomoc firmie w wyprodukowaniu co najmniej 300 milionów dawek szczepionki - jeśli okaże się ona bezpieczna i skuteczna - już w październiku 2020 r., zgodnie z oświadczeniem. Jest to część Operacji Warp Speed administracji Trumpa, inicjatywy, której celem jest dostarczenie 300 milionów dawek bezpiecznej i skutecznej szczepionki do stycznia 2021 roku, według HHS..
Sinovac Biotech
Według badań opublikowanych 3 lipca w czasopiśmie Science, inna kandydująca szczepionka, zwana (PiCoVacc), opracowana przez Sinovac Biotech z siedzibą w Pekinie, chroniła makaki rezus przed zakażeniem nowym koronawirusem. Firma, która już we wczesnych badaniach klinicznych wykazała, że szczepionka jest bezpieczna i skuteczna, prowadzi rekrutację do badania klinicznego III fazy z udziałem 8870 uczestników w Brazylii, zgodnie z Clintrials.gov.
Ta szczepionka składa się z inaktywowanej wersji wirusa SARS-CoV-2. Inaktywowane szczepionki są martwą wersją patogenu wywołującego chorobę (w przeciwieństwie do osłabionych wirusów, które są żywymi szczepionkami), według Departamentu Zdrowia i Opieki Społecznej Stanów Zjednoczonych (HHS). Inaktywowane wirusy, takie jak szczepionka przeciw grypie lub szczepionka przeciwko wirusowemu zapaleniu wątroby typu A, zazwyczaj nie zapewniają takiej ochrony jak żywe szczepionki i według HHS mogą z czasem wymagać zastrzyków przypominających. Przeciwnie, szczepionka Oxford jest osłabioną formą żywej szczepionki, która może wywołać długotrwałą odpowiedź immunologiczną, ale jest bardziej ryzykowna dla osób z osłabionym układem odpornościowym lub innymi problemami zdrowotnymi, zgodnie z HHS..
Sinovac rozpoczął badania fazy 1 / fazy 2 (z udziałem 743 zdrowych osób dorosłych) w kwietniu w prowincji Jiangsu w Chinach. Zgodnie z oświadczeniem podali uczestnikom dwie dawki szczepionki w odstępie dwóch tygodni i poinformowali, że szczepionka nie spowodowała żadnych poważnych zdarzeń niepożądanych. Autorzy badania stwierdzili również, że u ponad 90% uczestników pojawiły się przeciwciała neutralizujące szczepionkę dwa tygodnie po otrzymaniu drugiej dawki. Jednak ich wyniki zostały opublikowane tylko w komunikacie prasowym i nie zostały jeszcze opublikowane w recenzowanym czasopiśmie. Firma prowadzi obecnie badanie fazy 2 na starszych osobach dorosłych, a później przeprowadzi je na dzieciach i młodzieży, zgodnie z innym oświadczeniem. Sinovac wcześniej używał tej samej technologii do tworzenia zatwierdzonych szczepionek przeciwko wirusowemu zapaleniu wątroby typu A, wirusowemu zapaleniu wątroby typu B i świńskiej grypie, ptasiej grypie i wirusowi wywołującemu chorobę rąk, pryszczycy i jamy ustnej, według STAT News.
Moderna / National Institute of Allergy and Infectious Diseases

Zgodnie z poprzednim raportem ta kandydata na szczepionkę (mRNA-1273), opracowana przez amerykańską firmę biotechnologiczną Moderna i National Institute of Allergy and Infectious Diseases (NIAID), była pierwszą przetestowaną na ludziach w USA..
Szczepionka Moderna opiera się na technologii, której dotychczas nie stosowano w żadnej zatwierdzonej szczepionce: na fragmencie materiału genetycznego zwanego informacyjnym RNA (mRNA). Tradycyjne szczepionki składają się z osłabionych lub nieaktywnych wirusów lub białek tych wirusów, aby wywołać odpowiedź immunologiczną; Z drugiej strony szczepionki mRNA składają się z materiału genetycznego, który uczy komórki samodzielnego budowania tych białek wirusowych (w tym przypadku białka kolczastego koronawirusa). Zarówno szczepionki tradycyjne, jak i mRNA wywołują odpowiedź immunologiczną w organizmie, tak że jeśli osoba jest naturalnie narażona na wirusa, organizm może go szybko rozpoznać i zwalczyć.
Te szczepionki mRNA mają kilka zalet, w tym są szybsze i łatwiejsze w produkcji niż tradycyjne szczepionki, których opracowanie może zająć trochę czasu, ponieważ naukowcy muszą hodować i inaktywować całe patogeny lub ich białka, według National Geographic. Szczepionki mRNA mogą być również trwalsze przeciwko patogenom, które mają tendencję do mutacji, takim jak koronawirusy i wirusy grypy. Jednak szczepionki mRNA mogą powodować niepożądane reakcje w organizmie; te typy szczepionek mają również problemy ze stabilnością, rozkładając się dość szybko, co może ograniczać siłę odporności, według National Geographic.
Szczepionki mRNA okazały się „obiecującą alternatywą” dla tradycyjnych szczepionek, ale „ich zastosowanie było do niedawna ograniczone przez niestabilność i nieefektywne” dostarczanie do organizmu, jak donosi grupa naukowców w przeglądzie z 2018 roku opublikowanym w czasopiśmie Nature Reviews Odkrycie narkotyków. „Niedawne postępy technologiczne w dużej mierze przezwyciężyły te problemy, a liczne platformy szczepionek mRNA przeciwko chorobom zakaźnym i kilku typom raka dały zachęcające wyniki zarówno w modelach zwierzęcych, jak i na ludziach”.
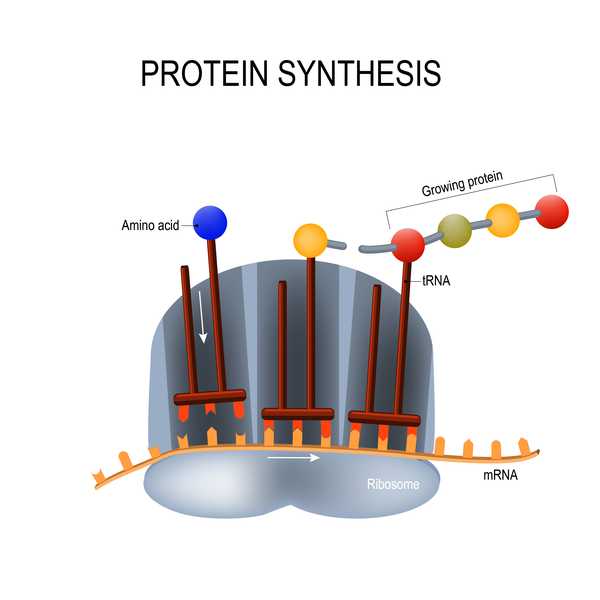
14 lipca Moderna opublikowała obiecujące wczesne wyniki badania fazy 1, w którym wzięło udział 45 uczestników w The New England Journal of Medicine. Uczestnicy zostali podzieleni na trzy grupy i otrzymali małą, średnią lub wysoką dawkę szczepionki. Po otrzymaniu dwóch dawek szczepionki wszyscy uczestnicy wytworzyli przeciwciała neutralizujące na poziomach powyżej średniej tych stwierdzanych u wyleczonych pacjentów z COVID-19..
Szczepionka wydawała się bezpieczna i ogólnie dobrze tolerowana, ale ponad połowa uczestników miała pewne skutki uboczne (podobne do skutków ubocznych, które mogą wystąpić przy corocznym szczepieniu przeciw grypie), w tym zmęczenie, dreszcze, ból głowy, bóle mięśni i ból w miejscu wstrzyknięcia . Niektórzy uczestnicy z grup otrzymujących średnią i wysoką dawkę doświadczyli gorączki po drugim wstrzyknięciu. Według raportu jedna osoba, która otrzymała najwyższą dawkę, doświadczyła „silnej” gorączki, nudności, zawrotów głowy i omdlenia. Ale ten uczestnik poczuł się lepiej po półtora dnia. Tak wysokich dawek nie otrzymają uczestnicy nadchodzących badań.
Testy fazy 2 Moderna wciąż trwają, a 27 lipca firma rozpoczęła testy fazy 3 w USA, zgodnie z raportem. Oczekuje się, że do końca lata do badania zakwalifikuje się około 30 000 uczestników, a pierwsze wyniki mogą być dostępne do listopada, zgodnie z raportem..
W kwietniu HHS, w ramach Operacji Warp Speed, zobowiązał się do wydania do 483 milionów dolarów na przyspieszony rozwój szczepionki Moderna.
28 lipca naukowcy opublikowali nowy artykuł w The New England Journal of Medicine, w którym szczegółowo opisali, w jaki sposób szczepionka Moderna wywołała silną odpowiedź immunologiczną u makaków rezus. Po otrzymaniu 10 lub 100 μg szczepionki, a następnie druga dawka dwa tygodnie później (niektóre nie otrzymały szczepionki i służyły jako punkt porównawczy), małpy „prowokowano” lub narażono na działanie koronawirusa w 8. tygodniu. Naukowcy odkryli, że małpy rozwinęły się silna odpowiedź immunologiczna na wirusa, ponieważ ich układ odpornościowy wytwarzał zarówno przeciwciała neutralizujące, jak i limfocyty T. Dwa dni po ekspozycji małp na koronawirusa naukowcy nie mogli wykryć replikacji wirusa w nosie ani płucach, co sugeruje, że szczepionka chroniła przed wczesną infekcją. (Kontrastuje to z badaniami Uniwersytetu Oksfordzkiego przeprowadzonymi na małpach, które wydawały się zapobiegać rozwojowi zapalenia płuc u małp, ale nie zapobiegały zakażeniu się nowym koronawirusem).
CanSino Biologics / Beijing Institute of Biotechnology
Firma CanSino Biologics, we współpracy z Beijing Institute of Biotechnology, opracowała kandydat na szczepionkę wykorzystującą osłabiony adenowirus. W przeciwieństwie do szczepionki Oxford, która opiera się na adenowirusie, który infekuje szympansy, CanSino Biologics używa adenowirusa, który zakaża ludzi.
Wraz z Moderną grupa ta opublikowała również wyniki badania fazy 2 z 20 lipca w czasopiśmie The Lancet. W badaniu, które przeprowadzono w Wuhan (gdzie pojawiły się pierwsze przypadki koronawirusa), wzięło udział 508 uczestników, którzy zostali losowo przydzieleni do otrzymania jednej z dwóch różnych dawek szczepionki lub placebo.
To badanie również nie wykazało poważnych zdarzeń niepożądanych, chociaż niektóre zgłaszały łagodne lub umiarkowane reakcje, w tym gorączkę, zmęczenie i ból w miejscu wstrzyknięcia. Według badania około 90% uczestników rozwinęło odpowiedź komórek T, a około 85% wytworzyło przeciwciała neutralizujące..
„Wyniki obu badań dobrze rokują dla badań fazy 3, w których szczepionki muszą być testowane na znacznie większej populacji uczestników, aby ocenić ich skuteczność i bezpieczeństwo” - powiedział Naor Bar-Zeev i William J Moss, obaj będący częścią International Vaccine Johna Hopkinsa Access Center, napisał w komentarzu towarzyszącym w The Lancet, odnosząc się do tego badania i badania szczepionek Oxford opublikowanego w tym samym czasopiśmie. „Ogólnie rzecz biorąc, wyniki obu prób są zasadniczo podobne i obiecujące”.
Według agencji Reuters chcą teraz przeprowadzić fazę 3 procesu poza Chinami.
Sinopharm
Kandydat na szczepionkę będącą własnością państwową China National Pharmaceutical Group (Sinopharm) jest inaktywowaną formą SARS-CoV-2. 13 sierpnia firma opublikowała dane z badań klinicznych fazy 1 i 2 w czasopiśmie JAMA. W badaniu fazy 1 96 zdrowych dorosłych zostało losowo przydzielonych do grupy otrzymującej małą, średnią lub wysoką dawkę szczepionki lub do grupy otrzymującej wodorotlenek glinu jako placebo. Otrzymali drugą i trzecią dawkę szczepionki (lub placebo) odpowiednio po 28 i 56 dniach. Naukowcy odkryli, że szczepionka pobudziła ich organizm do produkcji przeciwciał neutralizujących. Wśród uczestników, którzy otrzymali placebo, 12,5% miało działania niepożądane. Według badania u osób, które otrzymały szczepionki w małych, średnich i wysokich dawkach, odpowiednio 20,8%, 16,7% i 25% miało łagodne działania niepożądane. W badaniu fazy 2 224 dorosłym podano średnią dawkę lub placebo, a następnie drugi zastrzyk 14 lub 21 dni po pierwszym. Ponownie uczestnicy wytworzyli przeciwciała neutralizujące i zgłosili pewne łagodne reakcje niepożądane. Najczęstszym działaniem niepożądanym był ból w miejscu wstrzyknięcia, a następnie niewielka gorączka. „Nie odnotowano żadnych poważnych działań niepożądanych” - napisali autorzy.
Firma rozpoczęła już trzecią fazę próbną w Abu Zabi, w ramach której według agencji Reuters zostanie zatrudnionych do 15 000 osób. Według agencji Reuters uczestnicy otrzymają jeden z dwóch szczepów szczepionki lub placebo.
Pfizer / BioNTech / Fosun Pharmaceutical
Pfizer i niemiecka firma biotechnologiczna BioNTech, podobnie jak Moderna, opracowują szczepionkę, która wykorzystuje informacyjny RNA, aby skłonić układ odpornościowy do rozpoznania koronawirusa.
Szczepionka nie spowodowała żadnych poważnych zdarzeń niepożądanych i mogłaby pobudzić odpowiedź immunologiczną, zgodnie z danymi z wczesnej fazy 1 / fazy 2 opublikowanymi w bazie danych preprint medRxiv 1 lipca i która nie została jeszcze zweryfikowana. W badaniu wzięło udział 45 pacjentów, którym podano jedną z trzech dawek potencjalnej szczepionki lub placebo. Żaden z pacjentów nie miał poważnych skutków ubocznych, ale u niektórych wystąpiły działania niepożądane, takie jak gorączka (75% w grupie o najwyższej dawce), zmęczenie, bóle głowy, dreszcze, bóle mięśni i stawów.
Naukowcy odkryli, że szczepionka pobudziła układ odpornościowy do wytworzenia przeciwciał neutralizujących na poziomie 1,8 do 2,8 razy wyższym niż te stwierdzane u wyleczonych pacjentów. Później Pfizer ogłosił nowe wyniki (w komunikacie prasowym, więc odkrycia nie są recenzowane), że szczepionka pobudziła również produkcję komórek T specyficznych dla nowego koronawirusa.
W tym tygodniu administracja Trumpa ogłosiła kontrakt na 1,95 miliarda dolarów z Pfizer i BioNTech na wyprodukowanie co najmniej 100 milionów dawek ich szczepionki do końca roku, jeśli okaże się, że jest ona bezpieczna i skuteczna (w razie potrzeby do 500 milionów dawek więcej) . Amerykanie otrzymaliby szczepionkę za darmo, według The New York Times. Wcześniej obie firmy ogłosiły porozumienie z Wielką Brytanią na 30 milionów dawek szczepionki, jeśli działa i zostanie zatwierdzona, zgodnie z oświadczeniem. Pfizer planuje rozpoczęcie w tym miesiącu fazy 3 na dużą skalę, a przegląd regulacyjny już w październiku, według Times.
Janssen Pharmaceutical Companies firmy Johnson & Johnson
Eksperymentalna szczepionka Janssen firmy Johnson & Johnson na COVID-19, zwana Ad26, jest również opracowywana z osłabionego adenowirusa. Ten typ szczepionki nazywany jest szczepionką opartą na wektorach, ponieważ wykorzystuje osłabiony wirus (wektor) do dostarczania informacji o patogenie do organizmu, aby pobudzić odpowiedź immunologiczną. W tym przypadku osłabiony adenowirus wykazuje ekspresję białka „spike” SARS-CoV-2. Janssen korzysta z tej samej technologii, co przy opracowywaniu szczepionki na wirus Ebola.
Naukowcy poinformowali 30 lipca w czasopiśmie Nature, że jeden strzał szczepionki Ad26 chronił makaki rezus przed zakażeniem SARS-CoV-2. W tym badaniu naukowcy przetestowali siedem nieznacznie różniących się typów prototypów szczepionki Ad26 i zidentyfikowali ten, który wytwarza największą liczbę przeciwciał neutralizujących. Po otrzymaniu wybranego wariantu małpy były następnie narażone na koronawirusa. Sześć z siedmiu małp, którym podano tę prototypową szczepionkę o nazwie Ad26.COV2.S, a następnie wystawiono na działanie koronawirusa, nie wykazało wykrywalnego wirusa w dolnych drogach oddechowych, a jedna wykazała bardzo niski poziom w nosie, zgodnie z oświadczeniem.
Obecnie trwają badania kliniczne fazy 1 / 2a firmy Johnson & Johnson Ad26.COV2.S w USA i Belgii. Oczekuje się, że do badania zakwalifikuje się 1045 zdrowych uczestników w wieku od 18 do 55 lat i powyżej 65 lat. Zgodnie z najnowszymi wiadomościami z firmy Johnson & Johnson sprawdzą oni bezpieczeństwo szczepionki, wszelkie skutki uboczne i odpowiedź immunologiczną, którą rozwinęli uczestnicy. . Będą również testować różne harmonogramy szczepień i dawki. Według Johnson & Johnson istnieją dalsze plany dotyczące kolejnego badania fazy 1 kandydata na szczepionkę w Japonii oraz badania fazy 2 w Holandii, Hiszpanii i Niemczech. Jeśli szczepionka okaże się bezpieczna i skuteczna w tych próbach, naukowcy rozpoczną badania fazy 3 we wrześniu z udziałem około 60 000 uczestników z całego świata..
Johnson & Johnson ogłosił niedawno porozumienie z rządem USA o wartości 1 miliarda dolarów na dostarczenie 100 milionów dawek szczepionki w USA, jeśli otrzyma zgodę lub zezwolenie na stosowanie w nagłych wypadkach od amerykańskiej Agencji ds.Żywności i Leków, zgodnie z oświadczeniem.
Zobacz wszystkie komentarze (2)














